高新區國際注冊eCTD找哪家
危機應對與應急遞交機制在公共衛生緊急事件(如COVID-19)中,EMA允許簡化eCTD序列,優先審評關鍵模塊并暫緩非數據。申請人可通過快su通道(FastTrack)提交yi苗或yao物的eCTD資料,審評周期可壓縮至6個月。此類申請需附feng險評估報告,并承諾后續補交完整數據。數據安全與長期存檔歐盟要求eCTD資料存檔期限至少為yao品上市后30年,EMA采用分布式存儲和區塊鏈技術確保數據不可篡改。申請人需定期備份本地副本,并使用符合GDPR要求的加密傳輸協議(如AS2)遞交。歷史數據的遷移和格式轉換(如NeeS轉eCTD)需遵循特定技術規范。huan保效益與可持續發展eCTD取代紙質遞交后,歐盟每年減少約500噸紙張消耗,審評流程的數字化降低碳足跡約30%。虛擬審評會議和電子簽名進一步減少了差旅需求,契合歐盟2050碳中和目標。未來,。 澳大利亞IND注冊申報相關技術支持。高新區國際注冊eCTD找哪家
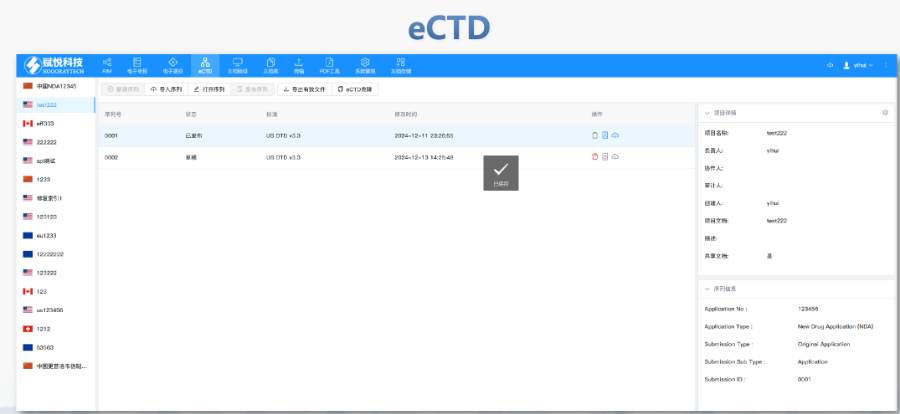
eCTD的法規框架與技術規范:歐盟eCTD的fa規層級包括指南(Guidelines)、指令(Directive)和fa規(Regulation)。其中,fa規(如CTR)具有直接fa律效力,而指南(如ICH eCTD規范)則為技術操作提供參考。eCTD的結構需符合歐盟模塊1規范(DTD 3.0+),包含行政文件(模塊1)、質量數據(模塊3)及臨床研究報告(模塊5)等內容,并通過XML文件實現數據互聯。例如,CEP(歐洲yao典適用性證書)的eCTD申報需單獨構建信封(Envelope)和模塊1,并指定標識符(UUID)以確保技術合規性。浙江NDAeCTD遞交加拿大eCTD注冊外包相關技術支持。
2015年發布《關于yao品醫療器械審評審批制度的意見》,提出yao監五大目標,將eCTD納入guo家yao監數字化戰略。2017年,中guo加入ICH(guo際人用yao品注冊技術協調會),成為全球第八個監管機構成員,加速與guo際標準接軌。2018年,guo家yao監局(NMPA)完成eCTD文檔管理系統招標,由上海寶信與德國LORENZ合作搭建技術平臺,標志著技術基礎設施的落地。規范制定與試點階段(2019-2023年)2019-2020年,CDE(yao品審評中心)發布《eCTD技術規范》《驗證標準》等征求意見稿,并zu織兩輪企業測試。2021年,NMPA明確化學yao1類、。2022年實施電子申報(非eCTD格式),2023年取消紙質資料提交,為eCTD鋪開奠定基礎。實施與擴展階段(2024-2025年)2024年3月更電子申報技術要求,7月啟動網絡傳輸試點。2025年1月27日,NMPA將eCTD適用范圍擴大至化yao1-5類臨床試驗及上市申請、生wu制品1-3類全流程,覆蓋yao、仿制yao及生wu類似yao,實現與guo際主流申報模式同步。
《ZHONG國eCTD驗證實踐手冊》作為2025年2月發布的技術指南(發布日期見),為YAO品注冊申請人提供了系統化的eCTD申報驗證操作指引。該手冊基于《ZHONOG國eCTD驗證標準》的框架,重點覆蓋驗證流程中的六大關鍵領域:基礎識別、文件/文件夾規范、ICH骨架文件完整性、區域性管理信息校驗、研究標簽文件(STF)邏輯性及PDF技術合規性。手冊特別強調對"錯誤警告提示"三級驗證結果的差異化處理策略,指導申請人通過賦悅eCTD軟件進行元數據填報、STF節點配置及擴展節點合規性檢查,同時針對ZHONG國特有的注冊類型差異提出模塊化申報資料準備方案。對于PDF文檔,手冊細化到書簽路徑、超鏈接屬性及字體嵌入等技術細節,確保電子資料符合CDE審評系統的解析要求。此外,手冊還結合SHENG物制品與化學YAO品的申報差異,明確了,并通過案例解析說明函與申請表生命周期的管理規則。 瑞士eCTD驗證標準相關技術支持。
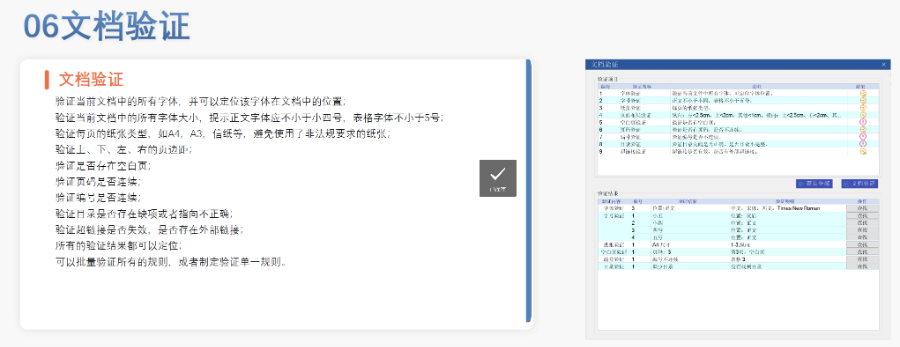
賦悅eCTD系統文件驗證與修復支持自動驗證文件格式(如PDF屬性、字體嵌入、超鏈接完整性等),并一鍵修復不符合法規要求的文件。例如,系統會自動檢查XML主干文件的結構合規性,確保符合zhong國、美國、歐盟等地區的eCTD法規標準。eCTD組裝與發布可自動生成符合CTD結構的電子文檔包,包括XML主干文件、文件夾命名規范及序列號管理(如申請號/序列號文件夾自動生成),并支持超鏈接和書簽的批量創建。例如,初次提交的序列號為0000,后續每次提交自動遞增。生命周期管理支持文件全生命周期操作(增、增補、替換、刪除),并通過序列號疊加直觀顯示各章節文件的you效性,覆蓋從初次提交到年報、撤市的全流程管理。協同與權限管理基于B/S架構(瀏覽器/服務器),支持云端或本地靈活部署,全集團賬號通用。提供多用戶協作功能,包括權限分級、審計追蹤、文件版本kong制等。法規支持與zhuan業服務內置符合zhong國CDE、美國FDA、歐盟EMA等法規的模板,同時提供注冊咨詢、資料撰寫、eCTD格式代轉等全流程支持,團隊擁有17年yao品注冊經驗。 歐盟CESP提交通道相關技術支持。浦東新區INDeCTD常用解決方案
eCTD申報相關技術支持。高新區國際注冊eCTD找哪家
仿制yao作為提高yao物可及性與可負擔性的一類yao物,2012年以前,注冊審評是不收取任何費用的,但當時仿制yao申請積壓嚴重,從申報到獲批需要3~5年的時間。美國國會于2012年頒布了仿制yao使用者費用修正案(GenericDrugUserFeeAmendments,GDUFA),該法律要求制yao行業支付一定的用戶費用,以補充仿制yao申請的審評以及現場檢查的費用,減少仿制藥申請積壓,縮短審評時間,增加基于風險的現場檢查等,其目的是加快公眾獲得安全you效的仿制yao,并降低行業成本。GDUFA必須每五年重授權一次,于2017年更(GDUFAII),于2022年更(GDUFAIII);目前收費種類分為以下四種:ANDA審評費、DMF審評費,在審評時一次性繳納;項目費(Programfee)、設施費(Facilityfee),是上市后每年繳納一次。 高新區國際注冊eCTD找哪家
- 楊浦區eCTD品牌 2025-12-20
- 河北仿制藥eCTD 2025-12-20
- 合肥NDAeCTD品牌 2025-12-20
- 吉林國際注冊eCTD 2025-12-20
- 無錫賦悅科技eCTD找哪家 2025-12-20
- 楊浦區國際注冊eCTD醫療科技 2025-12-20
- 徐匯區中國eCTD報價 2025-12-20
- 蘇州新藥eCTD 2025-12-20
- 北京加拿大eCTD 2025-12-20
- 靜安區CDE eCTD品牌 2025-12-20
- 揚州什么智慧消防電話 2025-12-24
- 半導體封裝公司 2025-12-24
- PEPS慢走絲軟件正版 2025-12-24
- 江西個性化廣告服務 2025-12-24
- K4A8G165WCBCPB存儲芯片教育電子研發領域 2025-12-24
- 全椒哪里通信網絡系統設計方案 2025-12-24
- 上海質量戶外裸眼3D零售價 2025-12-24
- 貴州個性化電商平臺軟件開發 2025-12-24
- 蘇州訂單管理系統開發操作 2025-12-24
- 徐州市場營銷策劃 2025-12-24