北京漢遜酵母宿主細胞蛋白(HCP)殘留檢測
來源:
發布時間:2025-11-07
樣品質量是影響宿主細胞蛋白(HCP)殘留檢測結果的因素之一。HCP 檢測覆蓋生物制品生產全流程,包含收獲、純化、制備等多個環節,不同樣品基質會導致 HCP 檢測結果存在明顯差異。以含佐劑的疫苗為例,佐劑會產生干擾,導致成品中難以檢測 HCP,因此通常在吸附工藝前的原液階段開展檢測。此外,樣品的收集、處理及保存方式也對檢測結果有重要影響。處理方式不當可能造成蛋白降解或變性,進而影響檢測結果。比如將歷史批樣品用作內部質控品時,需結合其穩定性數據,合理設定保存條件與保存期限,以此保障檢測方法的準確性和穩定性。
湖州申科自主開發的抗體覆蓋率驗證IMBS平臺經完善驗證,結果可靠,符合法規要求,可用于申報。北京漢遜酵母宿主細胞蛋白(HCP)殘留檢測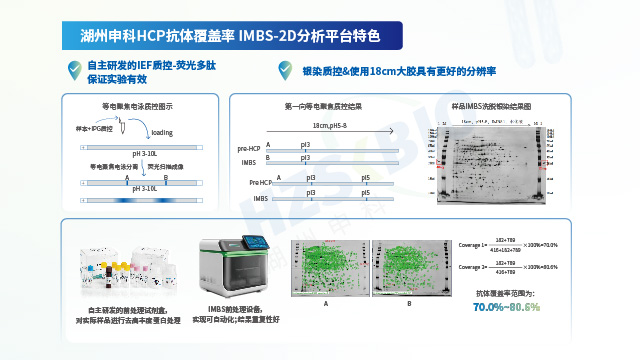
SHENTEK®AbunProteoX 是以磁珠為基礎構建的親和配體,適用于多種生物制品樣本。其操作流程經精心設計,簡化高效,方便用戶操作。與傳統非變性酶解方法相比,AbunProteoX 能有效提升 HCP 的檢出效果,有效降低質譜分析的檢測下限,使低豐度蛋白得以有效檢出,保障了檢測的高靈敏度。即便存在高豐度目標蛋白時,經 AbunProteoX 處理后,仍能有效分析宿主細胞蛋白(HCPs),為生物制品中宿主細胞蛋白殘留控制提供了簡便、易用且高效的樣品處理工具。
北京宿主細胞蛋白(HCP)殘留檢測常見問題分析HCP抗體能識別工藝中存在的HCP,避免有占優勢的抗體聚集,尤其關注潛在的高風險性HCP的識別能力。
定制化試劑盒之所以成為宿主細胞蛋白(HCP)殘留檢測的優先選擇,原因之一在于其構建的定制化檢測體系,更契合商業化生產中HCP工藝雜質的控制需求。在HCP校準品與HCP抗體這兩大關鍵試劑組分符合要求的基礎上,定制化方法的建立與優化依托真實的純化中間品及原液樣品開展,通過優化檢測條件提升對低濃度HCPs的檢測靈敏度,從而滿足工藝驗證與過程控制的需求。進入臨床三期階段,生產工藝需開展系統驗證,以保障工藝的穩定性與可重復性。此時,定制化HCPELISA檢測方法可更準確地監測生產工藝中HCP的去除成效,為工藝驗證提供堅實支撐。在過程控制環節,借助工藝特異型HCPELISA檢測方法,可實時監測生產過程中的HCP水平,擁有更強的生產異常預警能力,能及時排查生產風險,保障產品質量穩定。編輯分享將定制化試劑盒用于HCP殘留檢測的優勢分點列出推薦一些關于定制化試劑盒在HCP殘留檢測中應用的研究報告除了文中提到的方法,還有哪些可以提高HCP檢測靈敏度的技術?
湖州申科生物專注于研發貼合實際生產工藝的商業化宿主細胞蛋白(HCP)殘留檢測試劑盒,依托不同工藝下 HCP 的差異化分析,針對性推出各細分工藝領域的 HCP 檢測試劑盒。實驗數據顯示:針對 CHO-S 與 CHO-K1 兩種宿主細胞,兩類細胞共享 2458 種相同 HCP(占比 79.7%),但各自存在 392 種和 236 種特異性 HCP,充分體現工藝差異帶來的殘留蛋白特異性。進一步對比 B3 表達菌與 K2 克隆菌,盡管二者共享 1489 種相同蛋白(分別占比 88% 和 85%),但仍各自檢出 208 種和 258 種獨有蛋白,差異率為 12%-15%。這些結果直接證實,不同工藝路線與克隆株選擇會影響 HCP 殘留譜的構成。據此,湖州申科提出 “工藝定制化檢測” 策略:通過準確識別共性與特異性 HCP,針對性研發細分試劑盒產品。
HCP檢測的經典方法是ELISA法,但該方法在檢測過程中存在漏檢風險,需要對試劑盒抗體進行抗體覆蓋率評估。
由于 HCPs 屬于復雜的多分析物,為制備覆蓋率盡可能高的抗體(以覆蓋工藝特有的高風險 HCPs),需采用可靠的免疫策略。獲得符合性能要求的抗體后,需借助經過驗證的 2D 或 LC-MS 方法對抗體覆蓋率進行表征,確保抗體可充分覆蓋各實際工藝下產生的 HCPs。在擁有代表性抗原與優良性能抗體的基礎上,開展 ELISA 檢測體系開發,涵蓋原輔料篩選與制備研究、各組分工藝及反應體系研究、穩定性研究等重要內容。檢測體系開發完成后,需依據 ICH 及藥典要求開展分析方法驗證評估,確保體系的線性、范圍、檢測限、定量限、準確度、精密度、專屬性及耐用性均滿足法規要求。
總蛋白檢測差異是 HCP 免疫檢測結果不同的原因之一。北京漢遜酵母宿主細胞蛋白(HCP)殘留檢測HCP檢測方法驗證需評估線性范圍、中間精密度、靈敏度等關鍵參數。北京漢遜酵母宿主細胞蛋白(HCP)殘留檢測
定制化試劑盒之所以成為宿主細胞蛋白(HCP)殘留檢測的優先選擇,關鍵原因之一是其構建的檢測體系更契合商業化生產中HCP工藝雜質的控制需求。在HCP校準品與HCP抗體這兩大關鍵試劑組分達標后,定制化方法的建立與優化會依托真實的純化中間品及原液樣品開展——通過優化檢測條件提升對低濃度HCP的檢測靈敏度,從而滿足工藝驗證與過程控制的需求。臨床三期階段需對生產工藝開展系統驗證,以保障其穩定性與可重復性,而定制化HCPELISA檢測方法能更準確地監測工藝中HCP的去除效果,為工藝驗證提供堅實支撐。過程控制環節,借助工藝特異型HCP ELISA檢測方法,可實時監測生產過程中的HCP水平,擁有更強的生產異常預警能力,能及時排查生產風險,保障產品質量穩定。
北京漢遜酵母宿主細胞蛋白(HCP)殘留檢測
上一篇
北京化學制藥熱原檢測歐盟出口方案
下一篇:
宿主細胞殘留DNA檢測方法
相關新聞
- 浙江qPCR法宿主細胞殘留DNA檢測常用知識 2025-12-22
- 上海高效內毒素檢測動態顯色法鱟試劑 2025-12-22
- 上海高效內毒素檢測 2025-12-22
- 四川Vero宿主細胞殘留DNA檢測常用知識 2025-12-22
- 化學制藥內毒素檢測結果判定 2025-12-22
- 上海高效熱原檢測MAT試劑盒 2025-12-19
- PG13宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-12-19
- CHO宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-12-19
- 北京高效內毒素檢測商業化試劑盒 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
推薦新聞
- 青浦區生物檢測試劑盒多少錢 2025-12-23
- 蘇州名優軟霧吸入器工廠直銷 2025-12-23
- 國產聚甲醛哪里有賣的 2025-12-23
- 奉賢區包含什么醫療管理服務服務費 2025-12-23
- 微創手術用覆膜支架使用流程 2025-12-23
- 河南蛋白分離純化細分技術 2025-12-23
- 江西質量灌腸器生產企業 2025-12-23
- 廣東國產植物冠層光合氣體交換測量系統 2025-12-23
- 蘇州聚甲醛銷售廠家 2025-12-23
- 湖北醫用植絨拭子供應商家 2025-12-23