推薦新聞
-
htpvc板應(yīng)用與特點 上海泰晟供耐熱板
-
工程塑料如何提升銅箔生產(chǎn)質(zhì)量,常見應(yīng)用分享
-
三菱防靜電PVC 靜電防護非標(biāo)制品
-
供應(yīng)上海市上海塑料定制加工件按需定制報價上海泰晟電子科技供應(yīng)
-
華晟塑料定制加工 銅箔設(shè)備零部件上海泰晟電子科技供應(yīng)
-
碳纖維CFRP 非標(biāo)件 上海泰晟電子科技供應(yīng)
-
電解銅箔工藝流程_上海泰晟電子科技
-
提供上海市工程塑料價格報價上海泰晟電子科技供應(yīng)
-
上海泰晟與您分享塑料在晶圓生產(chǎn)周期中的5大應(yīng)用
-
提供上海市碳纖維清洗耐腐蝕支撐桿廠家上海泰晟電子科技供應(yīng)
福建重組藥物支原體檢測可比性驗證
來源:
發(fā)布時間:2025-11-11
支原體檢測 NAT 方法驗證需滿足全球藥典對檢測限、專屬性、耐用性、可比性等關(guān)鍵指標(biāo)的要求,且 EP、USP 新草案提出更嚴(yán)格標(biāo)準(zhǔn)。檢測限(LOD)方面,EP 要求針對每種支原體確定臨界值,需 3 次單獨 10 倍梯度稀釋、共 24 個檢測數(shù)據(jù),95% 檢出濃度達標(biāo);USP 要求標(biāo)準(zhǔn)菌株濃度≤10 CFU/mL 或 100 GC/mL,≥24 次檢測數(shù)據(jù)支持統(tǒng)計分析;ChP 未明確支原體專屬要求,但需滿足 “微生物檢出下限數(shù)量” 設(shè)定標(biāo)準(zhǔn)。專屬性上,EP 建議測試革蘭氏陽性菌交叉污染,USP 要求生信分析與實際樣品驗證結(jié)合,ChP 強調(diào)外來成分不干擾試驗。耐用性方面,EP 需驗證試劑濃度、提取與反應(yīng)程序變化,USP 涵蓋設(shè)備、反應(yīng)體系等參數(shù)波動。可比性上,EP 要求 NAT 法與藥典法 LOD 及特異性對比,替代培養(yǎng)法需達 10 CFU/mL,替代指示細胞法需達 100 CFU/mL,USP 則視樣品基質(zhì)情況要求可比性研究。
支原體標(biāo)準(zhǔn)菌株對支原體檢測試劑盒的選擇、使用及驗證至關(guān)重要。福建重組藥物支原體檢測可比性驗證
支原體 NAT 檢測的樣本結(jié)果需結(jié)合 FAM 信號與 VIC 信號的表現(xiàn)綜合判定,同時警惕抑制現(xiàn)象對結(jié)果的影響。若 FAM 信號 2 復(fù)孔有 1 孔以上 Ct<40 且呈有效 “S” 型擴增,VIC 信號 2 復(fù)孔 Ct<40 且呈有效 “S” 型擴增,判定為陽性;若 VIC 信號 2 復(fù)孔 Ct≥40 或無明顯擴增曲線,則為陽性但存在抑制。若 FAM 信號 2 復(fù)孔 Ct≥40 或無明顯擴增曲線,VIC 信號 2 復(fù)孔 Ct<40 且呈有效 “S” 型擴增,判定為陰性;若 VIC 信號同樣 Ct≥40 或無明顯擴增曲線,則陰陽性無法判斷且存在抑制。出現(xiàn)抑制現(xiàn)象需重測,重測仍有抑制時,陽性傾向樣本可適當(dāng)稀釋,陰性傾向樣本需優(yōu)化提取條件。
安徽疫苗產(chǎn)品支原體檢測指示細胞培養(yǎng)法湖州申科提供支原體檢測 qPCR 法方法學(xué)驗證服務(wù),含檢測限、專屬性、可比性等全維度驗證。
培養(yǎng)基的科學(xué)選擇與合規(guī)使用是支原體培養(yǎng)法檢測成功的基礎(chǔ),湖州申科按 USP 標(biāo)準(zhǔn)明確了三類推薦培養(yǎng)基的適用場景。Hayflick Media 用于支原體一般性檢測,F(xiàn)rey Media 專門針對滑液囊支原體檢測,F(xiàn)riis Media 則適用于非禽類支原體檢測。為確保少量支原體(約 100cfu 或 100ccu)不被遺漏,需使用足夠數(shù)量的固體與液體培養(yǎng)基開展檢測;若選用其他替代培養(yǎng)基,必須嚴(yán)格符合 USP 標(biāo)準(zhǔn)要求。此外,每批培養(yǎng)基均需進行針對性的微生物檢測(即營養(yǎng)特性測試),通過標(biāo)準(zhǔn)化的質(zhì)量把控,避免因培養(yǎng)基性能缺陷導(dǎo)致檢測失效,為后續(xù)檢測流程提供穩(wěn)定可靠的基礎(chǔ)條件。
湖州申科構(gòu)建了具有完備資質(zhì)的支原體技術(shù)服務(wù)平臺,為企業(yè)提供多元化支持。平臺擁有 BSL-2/P2 微生物實驗室備案資質(zhì),遵循 GMP-like 質(zhì)量體系,具備支原體培養(yǎng)法、指示細胞法與 qPCR 法的檢測及驗證能力,配備符合藥典要求的支原體標(biāo)準(zhǔn)菌株庫與高靈敏度培養(yǎng)基(含液體、固體、半流體)。企業(yè)已通過 ISO13485:2016 質(zhì)量管理體系認(rèn)證(證書號 MD 709873),檢測中心獲得 CNAS 認(rèn)證(注冊號 CNAS L21942),符合 ISO/IEC 17025:2017 標(biāo)準(zhǔn),具備國際互認(rèn)資質(zhì)。平臺可提供多元化技術(shù)服務(wù),包括支原體 qPCR 法檢測能力建立、實驗員能力考核、質(zhì)量體系與流程搭建、實驗室設(shè)計方案優(yōu)化,以及樣品檢測(三種方法)、樣品適用性驗證、方法學(xué)驗證、傳統(tǒng)法與 qPCR 法比對、特殊菌株定制生產(chǎn)等,申報階段可配合客戶與監(jiān)管機構(gòu)完成現(xiàn)場審計。
USP<77> 要求支原體檢測NAT法專屬性需經(jīng)生信分析與實際樣品驗證,排除近緣菌交叉反應(yīng)。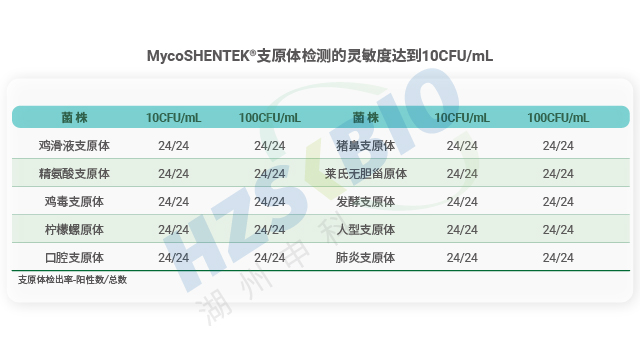
長期以來,支原體檢測主要依賴培養(yǎng)法和指示細胞法,且法規(guī)通常要求兩種方法同時使用,但這兩類方法存在明顯短板——培養(yǎng)法檢測周期長達 28 天,指示細胞法也需較長時間等待結(jié)果。隨著細胞療法藥物快速發(fā)展,其上市周期短、貨架期有限的特點,使得傳統(tǒng)方法難以滿足藥物放行的時效要求。核酸擴增技術(shù)(NAT)尤其是熒光探針 qPCR 檢測方法的出現(xiàn),憑借檢測速度快、特異性強的優(yōu)勢,成為支原體檢測的理想替代方案。作為替代方法,NAT 檢測需通過嚴(yán)格驗證以達到法規(guī)要求的靈敏度:檢測限達到 10CFU/mL 可替代培養(yǎng)法,達到 100CFU/mL 可替代指示細胞培養(yǎng)法,從而實現(xiàn)快速且可靠的支原體篩查。
支原體標(biāo)準(zhǔn)菌株在生物制藥與生物檢測行業(yè)中承擔(dān)著關(guān)鍵角色,其重要性將隨著生物制品的發(fā)展而愈發(fā)凸顯。安徽生物制品支原體檢測試劑盒湖州申科已為多家頭部企業(yè)提供支原體檢測方案,支持 BLA/NDA 申報。福建重組藥物支原體檢測可比性驗證
2023 年美國國立衛(wèi)生研究院(NIH)的對比研究得出一個結(jié)論是并非所有商業(yè)化支原體檢測試劑盒都能滿足替代傳統(tǒng)方法的要求,研究對市面上 5 款主流試劑盒(ATCC、梅里埃、賽默飛、羅氏、MB)進行測試,發(fā)現(xiàn)不同試劑盒對不同支原體菌株的檢測靈敏度差異明顯,部分產(chǎn)品無法達到宣稱的≤10 CFU/mL 檢測限(符合歐、日藥典替代培養(yǎng)法的要求)。例如,ATCC 試劑盒對萊氏無膽甾原體、精氨酸支原體的檢測限只為 100 CFU/mL,MB 試劑盒對硬蜱螺原體無法檢出(>1000 CFU/mL)。這一現(xiàn)象表明,試劑盒的檢測性能與支原體菌株特性密切相關(guān),因此企業(yè)需根據(jù)待測樣品的原輔料來源和檢測目的,對試劑盒進行嚴(yán)格的性能驗證,避免因檢測限不達標(biāo)導(dǎo)致質(zhì)量風(fēng)險。
福建重組藥物支原體檢測可比性驗證
下一篇:
河南熱原檢測法規(guī)要求
相關(guān)新聞
- 浙江qPCR法宿主細胞殘留DNA檢測常用知識 2025-12-22
- 上海高效內(nèi)毒素檢測動態(tài)顯色法鱟試劑 2025-12-22
- 上海高效內(nèi)毒素檢測 2025-12-22
- 四川Vero宿主細胞殘留DNA檢測常用知識 2025-12-22
- 化學(xué)制藥內(nèi)毒素檢測結(jié)果判定 2025-12-22
- 上海高效熱原檢測MAT試劑盒 2025-12-19
- PG13宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-12-19
- CHO宿主細胞蛋白(HCP)殘留檢測方法學(xué)驗證 2025-12-19
- 北京高效內(nèi)毒素檢測商業(yè)化試劑盒 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
推薦新聞
- 廣東混合痔痔瘡套扎器生產(chǎn)廠家 2025-12-23
- 遼寧單機交互廠家電話 2025-12-23
- 青浦區(qū)生物檢測試劑盒多少錢 2025-12-23
- 蘇州名優(yōu)軟霧吸入器工廠直銷 2025-12-23
- 國產(chǎn)聚甲醛哪里有賣的 2025-12-23
- 奉賢區(qū)包含什么醫(yī)療管理服務(wù)服務(wù)費 2025-12-23
- 微創(chuàng)手術(shù)用覆膜支架使用流程 2025-12-23
- 河南蛋白分離純化細分技術(shù) 2025-12-23
- 江西質(zhì)量灌腸器生產(chǎn)企業(yè) 2025-12-23
- 廣東國產(chǎn)植物冠層光合氣體交換測量系統(tǒng) 2025-12-23