北京疫苗熱原檢測
來源:
發(fā)布時間:2025-12-18
MAT 法熱原檢測的關鍵機制是 “熱原活化單核細胞 TLR 受體,觸發(fā)炎癥因子分泌”,TLR 受體的全覆蓋是保障檢測無遺漏的關鍵。不同熱原需活化不同 TLR 受體:最常見的內毒素(LPS)主要活化 TLR4,而革蘭氏陽性菌的非內毒素熱原(如脂磷壁酸)需活化 TLR2/6,真菌多糖活化?TLR2/4,病毒核酸活化 TLR3/7/8 等。因此,MAT 試劑盒配套細胞需具備全覆蓋的 TLR 受體表達—湖州申科生物通過 Western blot 驗證,其 HL-60 細胞系表達 TLR1-TLR9,可響應各類熱原。為進一步驗證覆蓋能力,申科用不同非內毒素熱原配體(如脂磷壁酸、酵母多糖)刺激細胞,結果顯示所有配體均能誘導 IL-6 分泌,且呈良好量效關系,證明試劑盒可檢出各類熱原。若細胞 TLR 受體覆蓋不全(如缺失 TLR2),則無法檢測革蘭氏陽性菌的非內毒素熱原,導致漏檢風險,因此 TLR 受體的全覆蓋是 MAT 法熱原檢測的關鍵技術指標之一。
熱原有廣譜來源特征,革蘭陰性菌(內毒素/LPS)致熱能力強,革蘭陽性菌、真菌、病毒均可產生。北京疫苗熱原檢測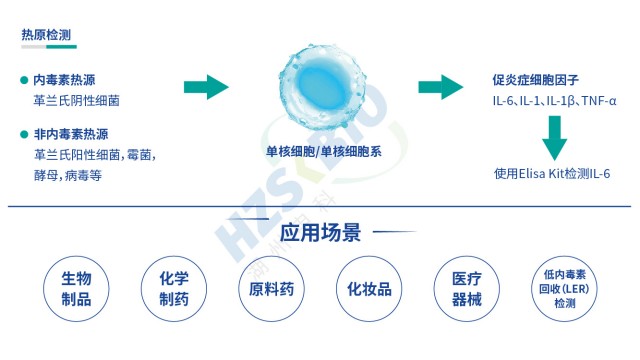
MAT法熱原檢測中,標曲信號值偏低或線性不佳是常見問題,需按細胞、標準品、ELISA 檢測三環(huán)節(jié)排查解決。細胞相關問題中,細胞復蘇后若未充分混勻導致結團,種板后細胞分布不均,會使局部信號弱,需振蕩細胞懸液后再種板;細胞活性差或處理時間超半小時,會降低炎癥因子分泌,需嚴格按說明書操作并縮短處理時間;孵育未達 37℃、5% CO?條件,細胞活化不足,需確保培養(yǎng)箱參數穩(wěn)定;細胞懸液若接觸外源熱原,會引發(fā)非特異性反應,操作時需遠離熱原污染源。標準品問題方面,配制稀釋錯誤會直接導致濃度不準,需核對稀釋步驟;振蕩時間不足(未按說明書要求)會使內毒素分散不均,需確保振蕩充分且 4 小時內使用;標準品降解會導致效價下降,需按推薦條件保存(如 - 20℃冷凍)。ELISA 檢測環(huán)節(jié),孵育時間短或振蕩速度慢會影響抗體結合,可適當延長孵育或提高振蕩速度;TMB 顯色不足(<3 分鐘)會導致信號低,需顯色 3-10 分鐘,待高濃度點 OD600 達 1.0 時加終止液。
熱原檢測體系MAT 法通過熱原活化單核細胞 TLR 受體,釋放 IL-6 等細胞因子,ELISA 檢測 IL-6 推算熱原含量。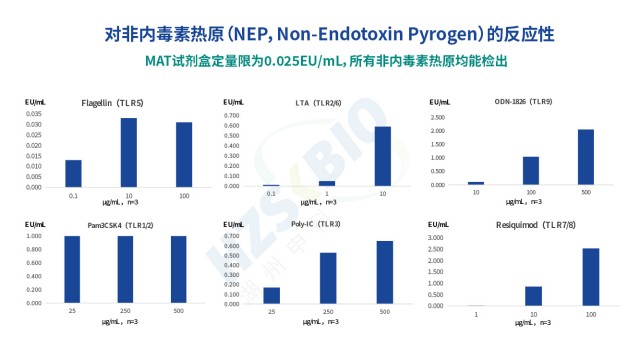
熱原檢測技術自 20 世紀初問世以來,經歷了 “動物試驗→體外生化檢測→細胞生物學檢測” 的三次關鍵變革,每一次變革均推動檢測效率、準確性與全面性的提升。20 世紀初至中期,熱原檢測方法只有家兔熱原試驗,通過觀察家兔體溫變化篩查熱原,雖實現了廣譜檢測,但存在動物成本高、操作繁瑣、靈敏度低、種屬差異大等局限,難以滿足制藥行業(yè)快速發(fā)展需求。20 世紀 60 年代,鱟試驗法(LAL 法)的發(fā)明開啟了熱原檢測的 “體外生化時代”,利用鱟血變形細胞裂解物的凝血級聯(lián)反應檢測細菌內毒素,靈敏度提升至 ng 級,檢測時間縮短至 1-2 小時,迅速成為制藥行業(yè)常規(guī)質控方法;但該方法依賴鱟資源,易受 β- 葡聚糖干擾,且只能檢測內毒素,無法覆蓋非內毒素熱原。21 世紀以來,重組技術與細胞生物學技術的發(fā)展推動熱原檢測進入 “全熱原管控時代”:重組級聯(lián)試劑(rCR)與重組 C 因子試劑(rFC)通過基因工程技術制備,擺脫對鱟資源的依賴,消除葡聚糖干擾,實現標準化生產;單核細胞活化反應測定(MAT)利用人源單核細胞檢測全類型熱原,填補非內毒素熱原檢測空白,且結果更貼近人體實際反應。
MAT法熱原檢測出現 “無信號”,需從試劑、實驗操作、儀器三方面定位原因并解決。試劑層面,抗體不足或失活會導致無法捕獲 IL-6,需核對抗體稀釋比例,檢查保存條件(如 2-8℃)與有效期,必要時更換試劑;底物失效(如變色、沉淀)會無法顯色,需觀察底物外觀,失效則更換;混合不同試劑盒試劑會因成分不匹配導致反應失敗,需使用同試劑盒試劑;ELISA 試劑盒保存不當(如反復凍融)會破壞試劑活性,需按說明書分條件保存(如抗體 2-8℃、底物避光)。實驗操作中,孵育溫度過低(<37℃)會抑制酶促反應,需提前將試劑與孔板平衡至室溫,確保孵育溫度達標;洗板機壓力過高或手動洗滌過猛,會洗去結合的抗體與酶,需調整洗板機壓力或輕柔手動洗滌;孵育時孔板未密封導致孔變干,會使反應體系破壞,需用封口膜密封孔板。儀器方面,洗板機噴頭堵塞會導致洗滌不均或未洗,需清理噴頭;酶標儀波長設置錯誤(未選 450nm)會無法檢測信號,需確認波長設置正確。
選擇熱原檢測單核細胞活化反應測定法,即是選擇更準確、更安全、更可持續(xù)的檢測方案。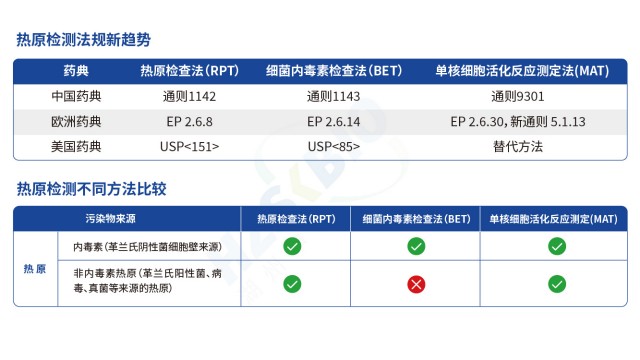
PBMC(外周血單個核細胞)的復雜制備流程嚴重制約熱原檢測效率。首先,血源獲取受獻血者數量、時間及采集血液政策限制,無法按需即時獲取;其次,需嚴格執(zhí)行 EP2.6.30 規(guī)定的標志物檢測,增加前期準備時間;再進行采集血液、分離單核細胞、凍存等環(huán)節(jié)需全程無菌操作,步驟繁瑣且易引入污染風險。相比之下,單核細胞系可工業(yè)化培養(yǎng),制備流程簡單可控,能快速提供合格細胞,避免因 PBMC 制備延誤熱原檢測進度,更適配批量樣品的高效質控。熱原進入血液后,TLR信號迅速活化NF-κB通路,驅動單核細胞釋放IL-1β、IL-6、TNF-α因子風暴。廣東熱原檢測歐盟出口方案
與傳統(tǒng)方法相比,MAT 法能更覆蓋各類熱原,保障產品安全性。北京疫苗熱原檢測
生物制品(如單克隆抗體、重組蛋白、細胞因子)因基質成分復雜(含高濃度蛋白質、螯合劑、表面活性劑、緩沖鹽等),在熱原檢測過程中易出現“反應抑制”或“非特異性增強”現象,嚴重影響檢測結果準確性。選擇抗干擾能力更強的檢測方法至關重要,重組級聯(lián)試劑(rCR)因采用完整級聯(lián)反應路徑,抗干擾性優(yōu)于天然 LAL;單核細胞活化反應測定(MAT)對復雜基質耐受性更高,通過適當稀釋即可消除多數干擾,因此生物制品熱原檢測常采用 “rCR 法(內毒素定量)+ MAT 法(全熱原篩查)” 的聯(lián)合方案,既保證內毒素檢測的準確性,又防控非內毒素熱原風險。
北京疫苗熱原檢測
上一篇
廣東生物制品內毒素檢測LER現象
相關新聞
- 浙江qPCR法宿主細胞殘留DNA檢測常用知識 2025-12-22
- 上海高效內毒素檢測動態(tài)顯色法鱟試劑 2025-12-22
- 上海高效內毒素檢測 2025-12-22
- 四川Vero宿主細胞殘留DNA檢測常用知識 2025-12-22
- 化學制藥內毒素檢測結果判定 2025-12-22
- 上海高效熱原檢測MAT試劑盒 2025-12-19
- PG13宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-12-19
- CHO宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-12-19
- 北京高效內毒素檢測商業(yè)化試劑盒 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
推薦新聞
- 廣西手術示教系統(tǒng) 2025-12-23
- 吉林腹腔鏡醫(yī)學影像工作站銷售價格 2025-12-23
- 吉林貨號高鹽核酸酶價格表 2025-12-23
- 貴州傷口敷料代加工 2025-12-23
- 蘇州質量干粉吸入器價位 2025-12-23
- 山東哪里有高鹽核酸酶銷售電話 2025-12-23
- 新疆無菌檢查隔離器 2025-12-23
- 什么是助踝器價格 2025-12-23
- 奉賢區(qū)本地鼻氧管電話多少 2025-12-23
- 江蘇醫(yī)療資產定位和能效管理方案批發(fā)價 2025-12-23