北京疫苗產品用宿主細胞蛋白(HCP)殘留檢測橋接驗證
來源:
發布時間:2025-12-16
湖州申科運用免疫磁珠分離技術(IMBS),搭配 2D 電泳或 LC-MS 技術評估抗體覆蓋率。IMBS 的主要流程涵蓋:多克隆抗體與磁珠的偶聯反應、磁珠未結合位點的封閉處理、HCP 樣本與結合抗體的磁珠共同孵育反應。該過程中,HCP 抗體會結合可識別的 HCP,未被識別的 HCP 則通過后續洗滌步驟去除,隨后借助低 pH 等洗脫條件,收集抗體捕獲的 HCP。此方法具備 AAE(抗體親和提取,Antibody Affinity Extraction)免疫層析柱分離的全部優勢,同時免疫磁珠可在懸浮狀態下與 HCP 樣品充分混勻并結合,HCP 結合效果更優;且依托磁珠吸附,能減少 HCP 與填料的非特異性吸附,進一步提升實驗準確性。
湖州申科全自動 HCP ELISA 系統實現從加樣到檢測自動化,提升效率。北京疫苗產品用宿主細胞蛋白(HCP)殘留檢測橋接驗證
依據美國藥典 1132 章節規定,HCPs 校準品需具備代表性,能夠覆蓋實際產品生產工藝中的 HCPs。結合 HCP 免疫檢測方法的使用目的與預期風險管理需求,為滿足工藝開發、驗證需求,同時應對下游工藝可能出現的異常失效或工藝變更情況,建議選用上游發酵工藝末端(如澄清處理后的工藝點)的樣本作為 HCPs 來源。實際制備時,可采用空細胞或空載細胞,在模擬實際工藝的預設條件下采集樣本,再通過二維電泳、高分辨率質譜等蛋白質組學技術,對模擬工藝與實際工藝下 HCPs 的代表性開展表征分析。越靠近下游工藝,HCPs 的蛋白種類越少,雖更接近成品(DS)中的 HCPs,但這類樣本可能無法滿足工藝開發與驗證需求,也難以覆蓋工藝潛在風險,因此通常不推薦使用,或只作為上游工藝 HCPs 免疫檢測方法的輔助材料。
浙江通用型宿主細胞蛋白(HCP)殘留檢測抗體制備為適配快速替換需求,湖州申科可應客戶要求,按生產工藝定制宿主細胞蛋白(HCP)商業化檢測試劑盒。
由于 HCPs 屬于復雜的多分析物,為制備覆蓋率盡可能高的抗體(以覆蓋工藝特有的高風險 HCPs),需采用可靠的免疫策略。獲得符合性能要求的抗體后,需借助經過驗證的 2D 或 LC-MS 方法對抗體覆蓋率進行表征,確保抗體可充分覆蓋各實際工藝下產生的 HCPs。在擁有代表性抗原與優良性能抗體的基礎上,開展 ELISA 檢測體系開發,涵蓋原輔料篩選與制備研究、各組分工藝及反應體系研究、穩定性研究等重要內容。檢測體系開發完成后,需依據 ICH 及藥典要求開展分析方法驗證評估,確保體系的線性、范圍、檢測限、定量限、準確度、精密度、專屬性及耐用性均滿足法規要求。
湖州申科生物在宿主細胞蛋白(HCP)ELISA 檢測技術領域具備扎實的技術積累,已搭建起高質量、全流程的自主開發平臺,覆蓋 HCP 檢測試劑盒研發的關鍵環節:①抗原表征與制備:依托合規平臺具備 HCP Reference/Antigen 制備能力,借助 2D 凝膠電泳等先進技術保障抗原庫的代表性;②動物免疫與抗體制備:憑借自有免疫動物平臺,把控免疫原設計及動物免疫過程,產出高特異性、廣覆蓋度的抗體;③體系開發與驗證:依靠成熟技術經驗開發高靈敏度、高穩定性的檢測體系,并嚴格遵循 GMP 標準完成方法學驗證。該平臺通過全流程自主可控的技術整合,從源頭保障試劑盒性能的一致性與可靠性,大幅降低不同批次試劑盒的檢測變異性。其研發的 HCP ELISA 試劑盒已服務國內外 200 余家生物醫藥企業,為單抗、疫苗等生物制品的工藝開發、質量控制及 IND/BLA 等法規申報,提供符合監管標準的定制化檢測方案。
對 宿主細胞蛋白(HCP)抗體的關鍵要求是識別工藝 HCP、規避優勢聚集,且突出潛在高風險 HCP 的識別能力。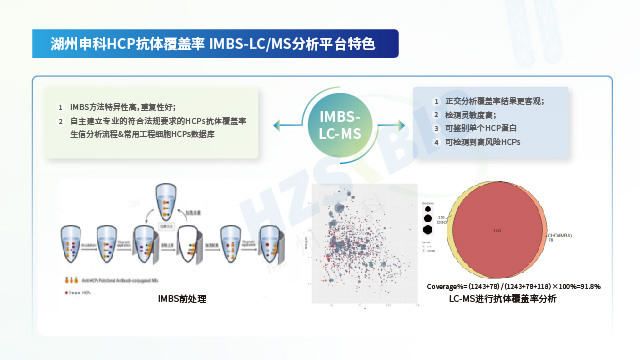
美國藥典 <1132> 與歐洲藥典 < 2.6.34 > 建議,對即將進入商業化生產(臨床 III 期及后續階段)或生產工藝已穩定的生物制品,采用定制化 ELISA 試劑盒開展宿主細胞蛋白(HCP)殘留檢測,背后原因主要包括四點:①確保檢測方法能充分覆蓋實際工藝產生的 HCPs,防止漏檢關鍵雜質;②為更準確的免疫原性與安全性評估提供支持;③提供真實的工藝表征數據,而非推測性數據;④滿足商業化生產質量控制對方法一致性的要求。此外,研究人員對當前市場常見的 HCP ELISA 商業化試劑盒進行測試,并將其與 HCP ELISA 定制化試劑盒對比。實驗結果顯示,不同商業化試劑盒檢測同一樣品的數值差異明顯,且準確性均低于定制化試劑盒 —— 這一結果表明,定制化試劑盒更能滿足產品質量控制的實際需求。
HCP具有異質性,體現在分子本身的多樣性以及和工藝相關的變異性。北京工藝特異型宿主細胞蛋白(HCP)殘留檢測試劑盒開發要求針對 HCP 檢測經典 ELISA 法的漏檢風險,需對試劑盒抗體進行覆蓋率評估。北京疫苗產品用宿主細胞蛋白(HCP)殘留檢測橋接驗證
HCP 是宿主細胞(多為哺乳動物細胞或微生物)所產生的蛋白質,這類蛋白質存在潛在風險,可能對藥物的安全性與有效性產生影響。因此,宿主細胞蛋白(HCP )殘留量成為生物藥物的關鍵質量屬性,需在藥物開發與生產階段,對 HCP 的存在進行嚴格監控、管理并做好記錄。隨著生產流程推進,生物制品純度逐步提升,但 HCP 的總量與種類也在不斷減少,這無疑增加了 HCP 分析與監測工作的難度。在此背景下,開發高效的 HCP 富集材料及技術便顯得尤為重要。低豐度宿主殘留蛋白富集試劑盒,專為富集生物制品(如單抗、融合蛋白等)中的 HCP 并去除高豐度蛋白而設計,其通過磁珠法構建多樣化且復雜的親和配體庫,以實現對目標蛋白的高效識別與結合。該試劑盒的設計不僅覆蓋傳統單一蛋白,還可適配融合蛋白、單克隆抗體等多種生物樣本類型,體現出較強的適用性與靈活性。北京疫苗產品用宿主細胞蛋白(HCP)殘留檢測橋接驗證
上一篇
廣東CHO宿主細胞殘留DNA檢測
相關新聞
- 浙江qPCR法宿主細胞殘留DNA檢測常用知識 2025-12-22
- 上海高效內毒素檢測動態顯色法鱟試劑 2025-12-22
- 上海高效內毒素檢測 2025-12-22
- 四川Vero宿主細胞殘留DNA檢測常用知識 2025-12-22
- 化學制藥內毒素檢測結果判定 2025-12-22
- 上海高效熱原檢測MAT試劑盒 2025-12-19
- PG13宿主細胞蛋白(HCP)殘留檢測常見問題分析 2025-12-19
- CHO宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-12-19
- 北京高效內毒素檢測商業化試劑盒 2025-12-19
- 北京通用型宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-12-19
推薦新聞
- 上海磁珠法高通量蛋白組學平臺 2025-12-24
- 脊髓誘發電位特點 2025-12-24
- 質量藏香地方 2025-12-24
- 福建人工低價定制義眼多少錢 2025-12-24
- 浦東新區國內健身器材批發 2025-12-24
- 性價比高的培養基的保質期 2025-12-24
- 陽江端粒長度基因檢測企業 2025-12-24
- 安徽口腔成型片 2025-12-24
- 重慶美容院拓客工具哪里有賣的 2025-12-24
- 重慶美容院拓客工具代理價格 2025-12-24